內容源自 網絡 僅供參考
在醫藥行業,冷庫是保障藥品、疫苗等生物制品質量的核心設施之一。無論是疫苗的低溫存儲,還是生物制劑的恒溫保存,冷庫的環境穩定性直接關系到產品的安全性和有效性。而GMP驗證標準中的4Q驗證(設計確認DQ、安裝確認IQ、運行確認OQ、性能確認PQ)正是確保冷庫從設計到運行全程合規的關鍵工具。本文將深入解析4Q驗證的全流程,為醫藥企業提供可落地的技術參考。
?一、4Q驗證的核心邏輯與價值?
4Q驗證并非簡單的“四步走”流程,而是一個環環相扣、逐步深化的系統性工程。其核心邏輯在于:通過科學驗證,確保冷庫的設計、安裝、運行和長期性能完全滿足藥品存儲的嚴苛要求,同時符合監管機構的合規性審查標準。
?冷庫驗證的意義?:
冷庫不同于普通倉儲設施,其溫度、濕度控制精度直接決定藥品的理化性質。例如,某生物藥在2-8℃環境下可穩定保存24個月,但若溫度短暫超標至10℃,其有效期可能縮短30%以上。冷庫驗證正是通過全流程測試,規避此類風險。
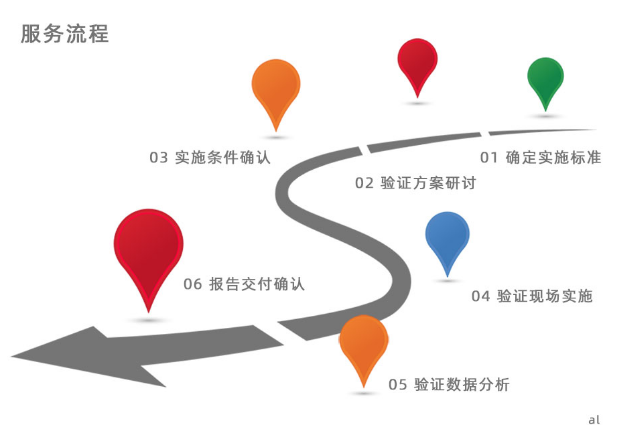
?4Q驗證的協同性?:
四個階段并非孤立存在,而是層層遞進。例如,設計確認(DQ)階段發現冷庫布局不合理,可能直接影響安裝確認(IQ)中的設備調試效率;運行確認(OQ)中的極端測試數據,又會成為性能確認(PQ)的基準參考。
?二、設計確認(DQ):從需求到圖紙的精準落地?
設計確認是冷庫建設的起點,其目標是將用戶需求(如存儲容量、溫控范圍)轉化為可落地的技術方案,并規避潛在設計缺陷。
?需求分析與技術轉化?
用戶需明確冷庫的核心功能需求,例如:存儲藥品類型(疫苗、血液制品等)、溫區劃分(如2-8℃、15-25℃)、庫存周轉頻率等。
技術團隊根據需求選擇制冷機組型號、保溫材料厚度、送風方式等。例如,高周轉率的冷庫需采用高效風幕機,減少開門時的溫度波動。
?設計圖紙的合規性審核?
重點關注冷庫的“熱分布合理性”。例如,制冷出風口的位置是否會導致局部過冷,貨架擺放是否阻礙空氣循環形成死角。
某企業曾因冷庫設計忽略緩沖區的溫控,導致裝卸貨時庫內溫度頻繁超標,最終通過增加獨立緩沖間解決。
?風險預判與設計優化?
提前模擬極端場景,如夏季高溫、斷電等情況下的冷庫性能。若發現制冷機組功率不足,需在DQ階段調整設計方案,避免后續返工。
未完,請關注下一篇
聲明:本文章來源于網絡,僅供參考交流,本站不對文中觀點及真實性負責,如有侵權請及時聯系本站刪除。































 電話 400 898 7116
電話 400 898 7116


