內容源自 山東藥監局
山東省藥品監督管理局
關于印發《山東省藥品監督管理局藥品經營監督檢查后處置工作程序(試行)》的通知
魯藥監規〔2022〕10號
各市市場監管局,省局各檢查分局、各直屬單位:
現將《山東省藥品監督管理局藥品經營監督檢查后處置工作程序(試行)》印發給你們,請認真貫徹執行。
山東省藥品監督管理局
2022年11月24日
(公開屬性:主動公開)
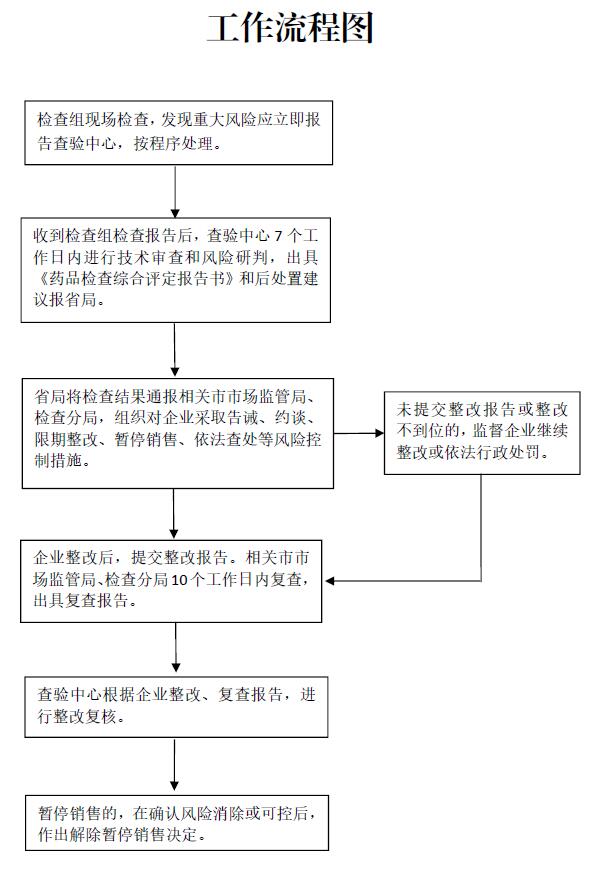
山東省藥品監督管理局藥品經營監督檢查后處置工作程序(試行)
一、適用范圍
本程序適用于山東省藥品監督管理局(以下稱省局)組織的對藥品經營企業監督檢查后實施告誡、約談、限期整改、暫停銷售、依法查處等風險控制措施(以下統稱后處置措施)。
二、引用文件
1.《中華人民共和國藥品管理法》
2.《中華人民共和國疫苗管理法》
3.《中華人民共和國藥品管理法實施條例》
4.《藥品流通監督管理辦法》(國家食品藥品監督管理局令第26號)
5.《藥品醫療器械飛行檢查辦法》(國家食品藥品監督管理總局令第14號)
6.《藥品檢查管理辦法(試行)》(國藥監藥管〔2021〕31號)
7.《藥品經營質量管理規范》(國家食品藥品監督管理總局令第28號)
8.《藥品經營質量管理規范現場檢查指導原則(2016版)》(食藥監藥化監〔2016〕160號)
三、術語與定義
(一)告誡
藥品監督管理部門對有證據證明可能存在安全隱患的,根據監督檢查情況依法采取的向藥品經營企業發出告誡信進行風險提醒和警示的風險控制措施。
(二)約談
藥品監督管理部門對有證據證明可能存在安全隱患,且未及時采取措施消除的,根據監督檢查情況依法采取的對藥品經營企業法定代表人、主要負責人進行警示談話,指出問題、明確要求、督促整改的風險控制措施。
(三)限期整改
藥品監督管理部門對有證據證明可能存在安全隱患,藥品經營活動偏離或者不符合質量管理規范、標準的,根據監督檢查情況依法采取的要求藥品經營企業在規定期限內采取糾正預防措施消除安全隱患的風險控制措施。
(四)暫停銷售
藥品監督管理部門依法對藥品經營企業采取暫停銷售藥品的風險控制措施,分為暫停全部經營范圍銷售、暫停部分經營范圍銷售、暫停風險藥品銷售三種。
(五)綜合評定結論
派出檢查單位在收到檢查組現場檢查報告后,對檢查報告進行審查,綜合判定其風險高低,作出的檢查綜合評定結論和后處置建議。
四、職責和權限
省局藥品市場監管處負責組織實施后處置工作。各市市場監管局、省局各檢查分局(以下稱檢查分局)按監管事權負責具體實施對藥品經營企業采取的后處置措施,對企業整改情況進行復查,對涉嫌違法行為進行依法查處。省食藥審評查驗中心(以下稱查驗中心)負責實施檢查、提供綜合評定結論等技術支撐工作。省(市)藥品檢驗機構負責監督檢查抽取樣品的檢驗工作。省局執法監察局(以下稱執法監察局)負責需省局直接查辦的涉嫌違法行為查處工作。現場檢查實行組長負責制,對現場檢查結果負責(工作流程圖見附件1)。
五、現場檢查結論及綜合評定結論
(一)現場檢查結論適用情形。檢查組根據現場檢查情況作出檢查結論。檢查結論分為以下三種:
1.未發現缺陷的,檢查結論為符合要求。
2.發現一般缺陷或者主要缺陷,但不影響整體藥品質量管理體系運行,不對藥品經營環節藥品質量造成影響,檢查結論為基本符合要求,包含但不限于以下情形:
(1)與《藥品經營質量管理規范》(以下簡稱GSP)有偏離,會引發低等級質量安全風險,但不影響藥品質量的行為;
(2)計算機系統、質量管理體系文件不完善,結合實際經綜合分析判定只對藥品質量管理體系運行產生一般影響。
3.發現嚴重缺陷,或者存在的主要缺陷和一般缺陷涉及企業質量管理體系運行,可能引發較嚴重質量安全風險,檢查結論為不符合要求,包含但不限于以下情況:
(1)企業質量負責人、質量管理部門負責人未負責藥品質量管理工作,不能正常履行職責;
(2)企業一直未按GSP要求使用計算機系統;
(3)儲存、運輸過程中存在對藥品質量產生影響的行為;
(4)其他涉嫌違反《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)等法律法規規章,需要立案查處的行為。
當藥品經營企業重復出現前次檢查發現的缺陷,表明企業沒有整改,或沒有采取適當的預防措施防止此類缺陷再次發生,風險等級可根據具體情況上升一級。
(二)綜合評定結論
查驗中心收到現場檢查報告后7個工作日內,對檢查情況進行技術審查和風險研判,出具《藥品檢查綜合評定報告書》和后處置建議報省局藥品市場監管處。查驗中心認為檢查組缺陷類型或結論判定有誤的,有權對缺陷類型或檢查結論進行調整。
六、后處置
(一)后處置措施適用情形。基于風險原則,將后處置工作分為以下五種情形:
1.符合以下情形的,采取告誡措施:
(1)綜合評定結論判定為基本符合要求,但存在一定質量風險,或綜合評定認為質量管理體系存在問題等;
(2)不符合各類專項藥品經營檢查標準的,存在潛在風險認為應當發出的;
(3)藥品監督管理部門認為需要采取告誡措施的其他情形。
2.符合以下情形的,采取約談措施:
(1)綜合評定結論判定為基本符合要求,但發現缺陷質量風險較大的,或者綜合評定結論判定為不符合GSP要求的;
(2)發現存在重大質量安全隱患未及時消除,可能危及公眾健康的;
(3)檢查發現的問題和缺陷多次發生的;
(4)多次被投訴舉報且核查屬實,或未及時妥善處理投訴舉報的藥品質量安全問題的;
(5)藥品監督管理部門認為需要約談的其他情形。
3.符合以下情形的,采取限期整改措施:
綜合評定結論判定為基本符合要求或不符合要求,對檢查發現的問題或缺陷提出書面限期整改措施,載明限期整改要求及時限。
4.符合以下情形的,采取暫停銷售措施:
(1)綜合評定結論判定為不符合要求,以及有證據證明可能存在重大質量安全隱患的,依據《藥品管理法》第九十九條規定,采取暫停銷售的風險控制措施,并依據《藥品管理法》第一百二十六條等相關規定進行處理;
(2)有充分證據證明藥品經營企業僅某一類藥品涉嫌不符合法規規范要求的,可只暫停某類別藥品銷售,可視情形同時責令藥品經營企業主動召回或追回有關藥品;
(3)有證據證明涉嫌違法違規,需立案調查,可先采取暫停藥品銷售防控風險措施。
5.符合以下情形的,依法查處:
(1)未遵守GSP的,依據《藥品管理法》第一百二十六條等規定查處。
(2)檢查發現的其他違法行為,依據相關法律法規的規定查處。
(二)采取后處置措施
1.組織實施后處置。省局藥品市場監管處根據查驗中心的綜合評定結論,起草后處置通知,組織相關市市場監管局、檢查分局依據后處置措施適用情形開展后處置工作,必要時由省局直接開展告誡、約談、暫停銷售等后處置工作。需要進一步風險會商的,組織有關處室單位、專家或法律顧問進行專題會商。
2.告誡、約談。由相關市市場監管局、檢查分局發出告誡信(式樣見附件2)、實施約談。
3.限期整改。由相關市市場監管局、檢查分局下達限期整改通知書(式樣見附件3)或在其他下達的書面文件中載明限期整改要求及時限等內容。
4.暫停銷售。由相關市市場監管局、檢查分局告知事實、理由、依據及陳述申辯權,下達《暫停銷售藥品風險控制措施通知書》(式樣見附件4),告知企業暫停銷售的經營范圍、時限和相關后處置措施等。企業可依法提起復議訴訟。相關市市場監管局、檢查分局應及時發布采取風險措施通告,并依據《藥品管理法》第一百二十六條等相關規定進行處理。
5.依法查處。相關市市場監管局、檢查分局依據《市場監督管理行政處罰程序規定》查處未遵守GSP等違法行為;需要由執法監察局直接辦理的,移交執法監察局辦理。相關案件結案后,應及時將處罰情況反饋省局。
(三)整改復查
1.提交整改報告。被檢查企業整改完成后,及時向相關市市場監管局或檢查分局提交整改報告。
2.整改復查。相關市市場監管局、檢查分局應當在收到整改報告后10個工作日內開展復查,出具復查報告(式樣見附件5),并按要求及時上傳至省局日常監管系統。對檢查結論為不符合要求的,相關市市場監管局、檢查分局應進行現場檢查,確保企業整改到位。
3.整改復核。查驗中心應基于風險研判和風險管控原則,對現場檢查報告、企業整改情況、各市市場監管局或檢查分局復查報告等進行復核。必要時可派檢查組進行現場復查。
(四)檢查結果通告
省局藥品市場監管處收到查驗中心的綜合評定結論后進行審核,報省局分管負責人批準后,依法應當公開的在20個工作日內發布檢查通告,完成檢查結果公開。
(五)解除暫停銷售風險控制措施
企業完成整改并由相關市市場監管局、檢查分局現場復查,查驗中心進行整改復核,省局藥品市場監管處進行風險評估,認為整改符合要求、風險消除或可控的,處室報省局分管負責人批準后,由相關市市場監管局、檢查分局向企業下達《解除暫停銷售藥品風險控制措施通知書》(式樣見附件6)。整改不符合要求的,由相關市市場監管局、檢查分局監督企業繼續整改或依法給予行政處罰。
七、其他
(一)檢查中發現被檢查單位涉嫌違法,或發現重大風險需采取緊急控制措施的,檢查組應第一時間將有關情況和處理建議報告查驗中心;查驗中心進行風險研判后立即報告省局藥品市場監管處,提出處理意見報省局分管負責人同意后,立即通知當地市市場監管局或檢查分局進行風險控制和調查處理。當地市場監管部門或檢查分局應立即派出執法人員到達檢查現場,開展風險控制和調查處理工作,有關情況及時報省局。
(二)藥品使用單位、藥品網絡交易第三方平臺的監督檢查以及國家藥監局組織的監督檢查后處置參照本程序執行。
本程序自2023年1月1日起施行,有效期至2024年12月31日。
聲明:本文章來源于網絡,僅供參考交流,本站不對文中觀點及真實性負責,如有侵權請及時聯系本站刪除。































 電話 400 898 7116
電話 400 898 7116


