GMP企業及供應商在冷庫驗證的DQ確認活動開始前及驗證過程中如何配合我們冷鏈驗證單位保證驗證活動的順利展開完成?DQ確認的具體實施流程如何?
一、冷庫驗證—DQ確認目的及作用
歐盟 GMP及中國 GMP2010 版要求設計確認作為整個確認活動的起點,新廠房、設施或設備的第一元素為設計確認。通過有文件記錄的方式證明所提出的廠房、系統和設備設計適用于其預期用途和 GMP 的要求,用科學的理論和實際的數據證明設計結果滿足 URS 需求。完善的設計確認是保證用戶需求以及設備正常發揮功效的基礎。
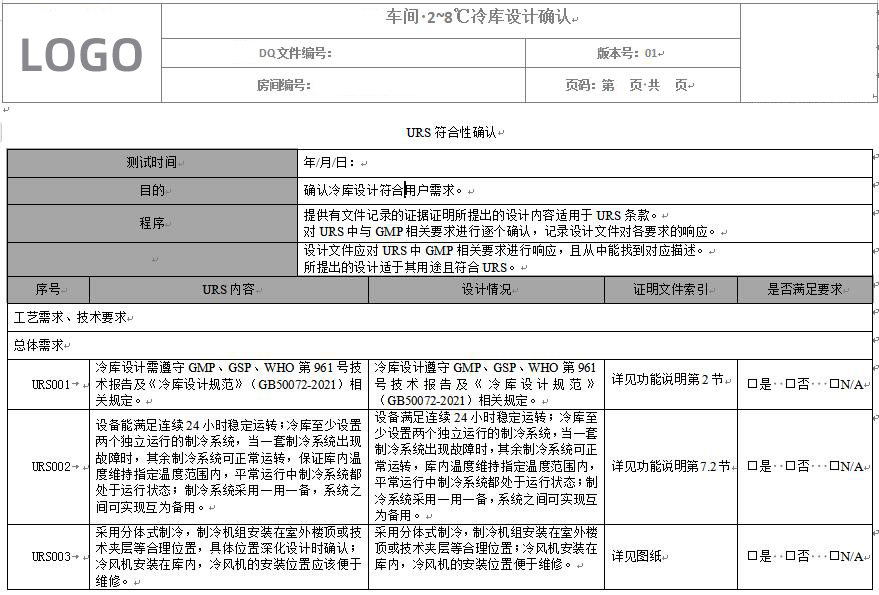
冷庫驗證中設計確認主要是對系統/設備選型和技術規格、技術參數和圖紙等文件的適用性的審查,通過審查確認系統/設備用戶要求說明中的各項內容得以實施。
二、冷庫驗證—DQ確認階段的流程
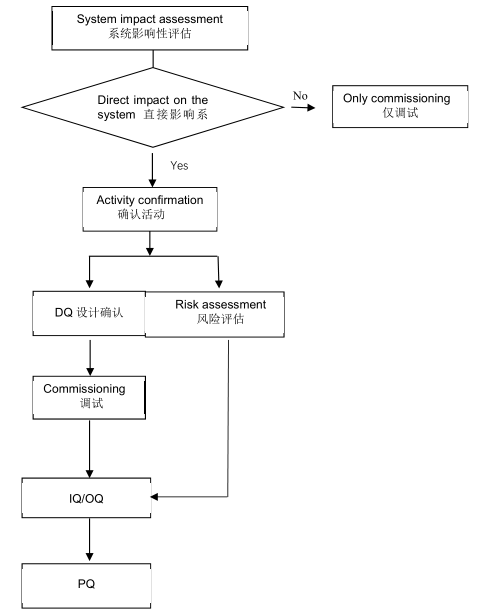
A.提供支持性文件
GMP企業或供應商提供的支持文件,主要包括的文件如下:
用戶需求說明(URS),URS 已經完成并審批,其中有足夠的設計細節應可以被應用
冷庫設備清單
系統/冷庫設備相關設計文件,包括圖紙、負荷計算書、設計說明DS、功能說明FS等。
B.方案編制
DQ整體文件包括了方案審批、先決條件、目的、系統描述、職責、驗收標準、偏差/調整和糾正措施、附件附錄等框架內容。GMP企業或供應商在執行確認活動前需審核和批準方案,并且保證在執行前所有的未完成項和先決條件得到滿足。
C.方案實施
設計確認的執行包括對 URS 和供應商提供設計文件進行對照檢查。包括圖紙、設備材質、安全等方面。在進行確認的時候,GMP企業或供應商提供必要的人員進行見證,并現場復核。
D.總結報告
總結 DQ 方案內各項測試數據,使之形成報告。設計確認結果應該根據GMP企業的要求及程序進行審核。
E.審批
根據總結報告內容數據,并確認執行完成及偏差評估之后,GMP企業需要對 DQ 執行批準/驗收;確認已執行 DQ 方案的簽收證實系統/設備的 DQ 已完成,所有確認項目均按方案要求完成,沒有遺漏,記錄完整真實,并且確認過程和結果均符合可接受標準。
IQ 可以進行。































 電話 400 898 7116
電話 400 898 7116


